- Reacties 181
- Bezichtigingen 44.3k
- Created
- Laatste reactie
Top Posters In This Topic
-
 Mania-92 23 posts
Mania-92 23 posts -
 Visser23 14 posts
Visser23 14 posts -
 Dutchy3010 10 posts
Dutchy3010 10 posts -
 Mr-Triple-X 8 posts
Mr-Triple-X 8 posts
Featured Replies
Recent actief 0
- Er zijn hier geen geregistreerde gebruikers aanwezig.






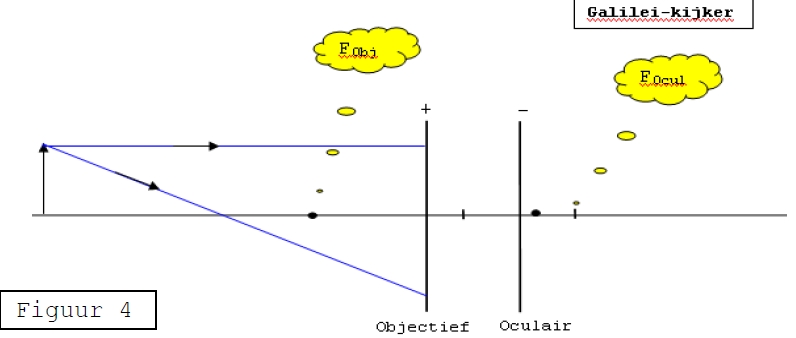
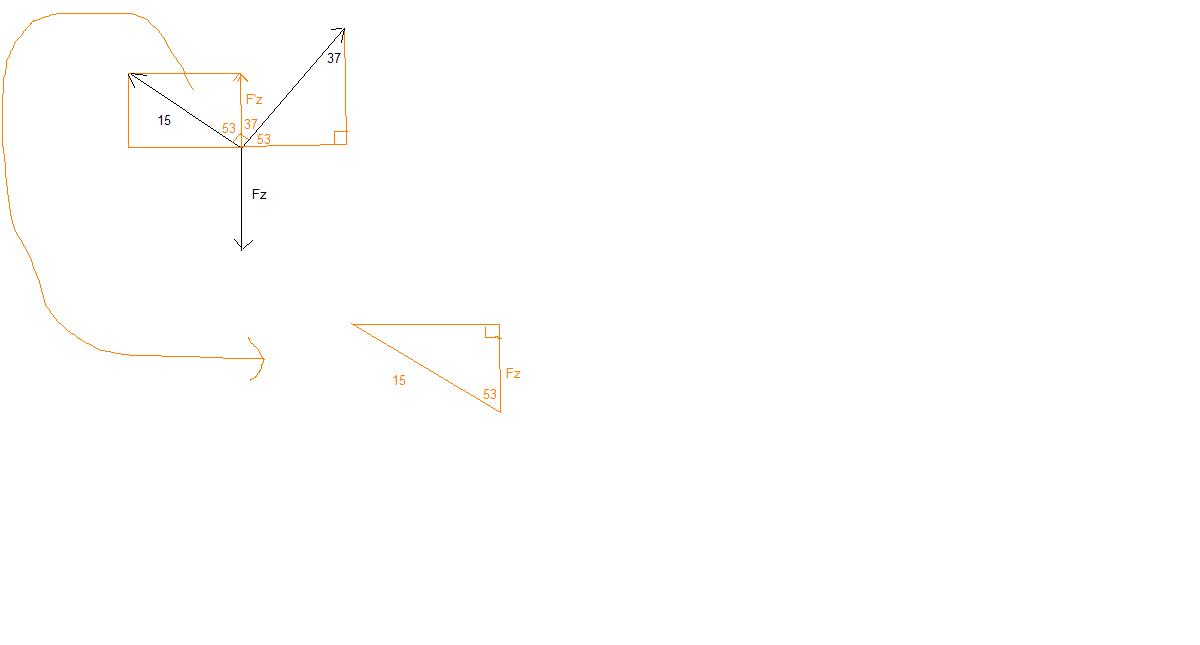
comment_795472Post hier je probleemstukken en vragen op het gebied van natuur- en scheikunde. Zoals vragen over het Periodiek Systeem der Elementen, wanneer het kookpunt wordt bereikt van de diverse metalen en vloeistoffen, de eerste wet van Newton en alle andere onduidelijkheden over deze vakken. Zoals altijd geldt: hulp & support is beschikbaar, pasklare antwoorden niet.....